Die Stabilisierung, der Umbau und die Reparatur biologischer Membranen sind entscheidende Aufgaben, mit denen eukaryontische Zellen die zelluläre Kompartimentierung aufrechterhalten, mit Membranschäden fertig werden und den kontrollierten Transmembrantransport von Molekülen und Ionen sicherstellen. In Eukaryonten ist an mehreren Prozessen des Membranumbaus das ESCRT-III-Protein beteiligt, die Kernkomponente der für den Transport erforderlichen endosomalen Sortierkomplexe (ESCRT). Kürzlich wurde gezeigt, dass ESCRT-III-Proteine auch in Bakterien konserviert sind, und das Mitglied der ESCRT-III-Superfamilie IM30 (inner membrane-associated protein of 30 kDa) bindet an Membranen, stabilisiert sie und baut sie um.. Diese Beobachtungen ermöglichen es uns nun, das bakterielle System im Detail zu untersuchen, um die konservierten molekularen Mechanismen des ESCRT-III-vermittelten Membranumbaus zu beschreiben.
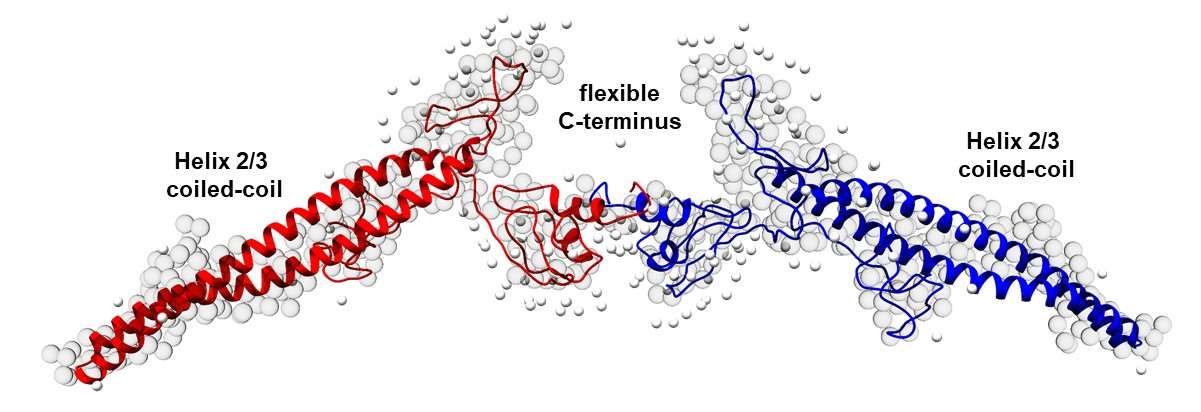
IM30-Monomere fügen sich zu großen homo-oligomeren Tonnenstrukturen zusammen, in denen die Monomere ~80% α-helical sind. Nach der Membranbindung lösen sich die Fässer auf, und der C-terminale Bereich des monomeren IM30 entfaltet sich. Die Kontakte zwischen den Monomeren in den Fässern induzieren also offenbar die Bildung von α-Helices. Darüber hinaus bildet IM30 beim Zerlegen des Fasses einen membranbedeckenden "Teppich", der die Membran stabilisiert. In Lösung bilden oligomerisationsgestörtes IM30 und der ungeordnete IM30-C-Terminus allein flüssige Kondensate durch einen Prozess der Flüssig-Flüssig-Phasentrennung. Die Bildung von IM30-Fässern induziert also nicht nur die α-Helixbildung, sondern scheint auch die Flüssig-Flüssig-Phasentrennung zu verhindern. Wir gehen davon aus, dass eine Erhöhung der Konzentration von ungefaltetem IM30 auf einer Membranoberfläche über die für die Phasentrennung erforderliche Sättigungskonzentration hinaus die Phasentrennung und die Bildung eines 2D-Kondensats auf der Membranoberfläche fördert; dies erinnert an die beobachteten großen Ansammlungen in vivo auf Membranoberflächen. In diesem Projekt werden wir den Übergang von der α-Helix zur ungeordneten Struktur von IM30 in Lösung und auf Membranoberflächen untersuchen, indem wir eine Kombination aus Molekulardynamiksimulationen, Biochemie und biophysikalischen Analysen mit fortschrittlichen spektroskopischen Methoden anwenden. Wir werden die primären Sequenzmerkmale und die physikalischen Eigenschaften der Kondensate mit den mutmaßlichen physiologischen IM30-Funktionen verknüpfen, indem wir eine sequenzgerichtete rechnerische und experimentelle Analyse durchführen.