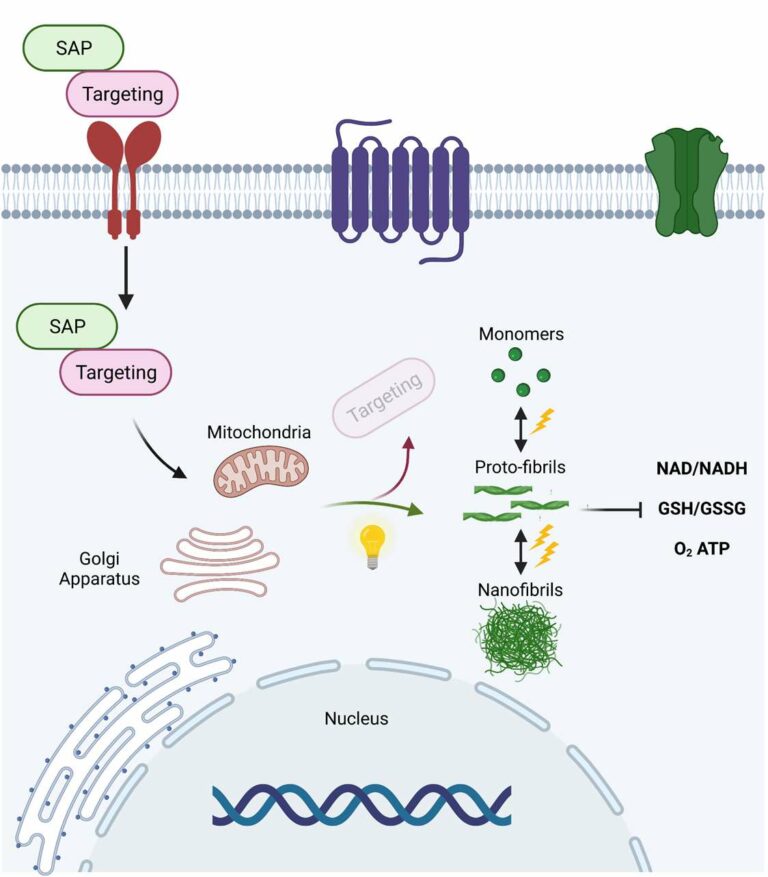
Die Aggregation von Proteinen zu Fasern im Inneren von Zellen ist ein allgegenwärtiger Prozess, der mit menschlichen Krankheiten in Verbindung gebracht wird, dessen molekulare Grundlagen und Auswirkungen auf die Zellfunktionen jedoch nur unzureichend verstanden werden. Der übliche Ansatz zur Lösung dieses Problems besteht darin, zu untersuchen, wie eine molekulare Fehlfunktion zur Proteinaggregation führt. Das vorgeschlagene Projekt folgt der entgegengesetzten Logik und wird lichtinduzierbare, phasengetrennte Polypeptidaggregate (Optoaggregate) erzeugen und charakterisieren, die sich in verschiedenen subzellulären Kompartimenten lebender Zellen zusammensetzen. Diese phasengetrennten Nanostrukturen werden biologische Funktionen allein durch Strukturbildung mit außergewöhnlicher räumlicher und zeitlicher Kontrolle beeinflussen. Nicht-assemblierende kurze Peptidvorläufer werden mit Bioerkennungseinheiten modifiziert, die eine zelluläre Aufnahme und eine Ausrichtung auf Organellen ermöglichen. Nach der Bestrahlung mit Licht durchlaufen die Peptidvorläufer verschiedene Stadien der Selbstassemblierung. Das Peptidgerüst bestimmt die Kinetik der supramolekularen Polymerisation, das Ausmaß der Phasentrennung, die Morphologie der gebildeten Nanostrukturen sowie deren rheologische Eigenschaften und Stabilität. Dementsprechend bietet die Bestrahlung mit Licht eine räumlich-zeitliche Kontrolle über das Verhältnis von Monomeren, Oligomeren, Proto- und reifen Nanostrukturen, indem die Menge der aktiven, zusammenbauenden Peptide zu einem bestimmten Zeitpunkt gesteuert wird. Diese Anteile der gebildeten phasengetrennten Nanostrukturen werden anschließend mit ihren Auswirkungen auf die Zellfunktionen, d. h. Lebensfähigkeit, Proliferation, Redox- und Kalziumdynamik, Stoffwechsel und Stressreaktionen, in Beziehung gesetzt. Indem wir die Möglichkeit bieten, den Ablauf der Strukturbildung in Zellen zu steuern, können wir ein vielseitiges Instrumentarium für die Untersuchung jedes Aggregationsstadiums in der gewünschten Zellart bereitstellen, was derzeit mit biologischen Mitteln nicht möglich ist. Letztendlich wird dieser Beitrag große Lücken in unserem Verständnis darüber schließen, wie Proteinaggregation und zelluläre Fehlfunktionen sich gegenseitig beeinflussen. Unsere Erkenntnisse werden neue Einblicke in den Mechanismus und das Fortschreiten von Proteinaggregationskrankheiten geben und damit die Aussichten auf Therapien verbessern.