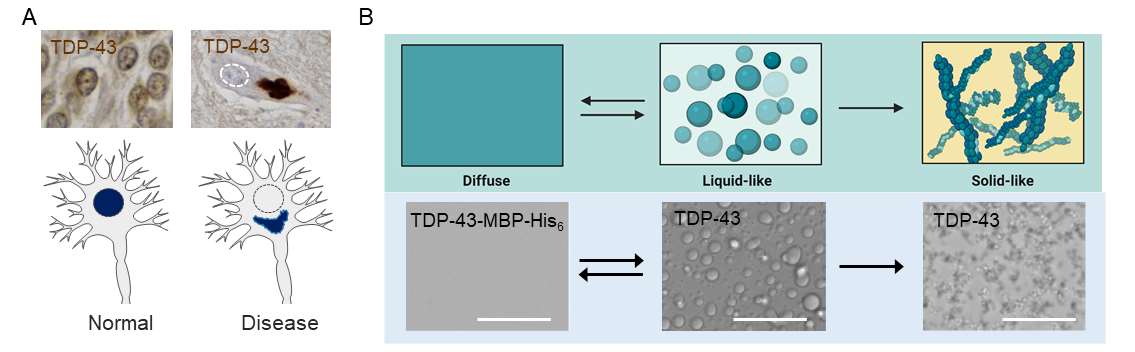
Posttranslationale Modifikationen (PTM) spielen eine wichtige Rolle bei der Veränderung der Proteinfunktion und der Zellphysiologie, sind aber auch mit vielen Krankheiten, einschließlich neurodegenerativer Störungen, verbunden. Mehrere Proteine, die bei neurodegenerativen Patienten unlösliche Aggregate bilden, z. B. Tau bei der Alzheimer-Krankheit und TAR DNA-binding protein of 43 kDa (TDP-43) oder fused in sarcoma (FUS) bei amyotropher Lateralsklerose (ALS) und frontotemporaler Demenz (FTD), sind stark posttranslational modifiziert. Es ist jedoch weitgehend unklar, wie diese PTMs das molekulare und polymere Verhalten eines Proteins oder seine funktionellen Eigenschaften in Zellen verändern, und es ist auch nicht bekannt, welche PTMs spezifisch für physiologische Bedingungen sind und welche mit Pathologie in Verbindung stehen.
Anhand einer Kombination aus biochemischen und zellulären Studien (Dormann) und Multiskalen-Simulationen (Stelzl) wollen wir die Rolle von PTMs bei den mit Neurodegeneration verbundenen RNA-bindenden Proteinen TDP-43 und FUS verstehen. In der ersten Förderperiode werden wir uns auf bekannte krankheitsassoziierte PTMs konzentrieren, insbesondere auf die Hyperphosphorylierung von TDP-43 und die Arginin-Methylierung in FUS. Wir werden das Phasentrennungs- (PS)/Aggregationsverhalten von TDP-43-Spezies untersuchen, die definierte phosphomimetische Mutationen oder Phosphosites in verschiedenen Regionen tragen, und wir werden die Wechselwirkungen von unterschiedlich modifizierten TDP-43-Spezies mit negativ geladenen Biopolymeren [RNA, ssDNA, Poly(ADPribose) (PAR)] sowie ihre Lokalisierung und RNA-verarbeitenden Funktionen in Zellen untersuchen. Darüber hinaus werden wir untersuchen, wie sich die Arginin-Methylierung der FUS-RGG/RG-Regionen auf die strukturellen und physikalischen Eigenschaften von FUS-Kondensaten auswirkt, einschließlich der Bildung von mesoskaligen Clustern, der Koazervation mit RNA, ssDNA und PAR, sowie der RNA-Bindungsspezifität von FUS. Schließlich werden wir versuchen, eine Pipeline zur Identifizierung von physiologischen und Stress-/Islokalisierungs-induzierten PTMs auf TDP-43 und FUS mit Hilfe der Proteomik aufzubauen, wobei wir in dieser Förderperiode mit der Phospho-Proteomik beginnen. Langfristig wird uns dieser Ansatz in die Lage versetzen, physiologische und krankheitsbedingte PTMs von TDP-43 und FUS zu identifizieren und ihre Auswirkungen auf das PS/Aggregationsverhalten der Proteine, auf ihre Interaktionen mit anderen Biopolymeren sowie auf ihre zelluläre Lokalisierung und physiologischen Funktionen zu verstehen. Wir werden das Paradigma des Phasenverhaltens von Proteinen durch assoziative Polymere ergänzen, homo- und heterotypische Wechselwirkungen bei der Selbstassemblierung untersuchen und die molekularen Antriebskräfte der Koazervation von Proteinen mit Nukleinsäuren aufklären.
Verwandte Veröffentlichungen:
- L. A. Da Gruijs Silva, F. Simonetti, S. Hutten, ..., V. Dötsch, D. Edbauer, G. Hummer, L. S. Stelzl, D. Dormann*, Die krankheitsbedingte TDP-43-Hyperphosphorylierung unterdrückt die TDP-43-Kondensation und -Aggregation. EMBO J., e108443 (2022).
- E.L. Sternburg, L.A. Gruijs da Silva, D. Dormann*, Posttranslationale Veränderungen an RNA-bindenden Proteinen: Beschleuniger, Bremsen oder Passagiere bei der Neurodegeneration? Trends Biochem. Sci. 47, 6 (2022).
- M. Hofweber#, S. Hutten#, ..., T. Madl, D. Dormann*, Die Phasentrennung von FUS wird durch seinen nuklearen Importrezeptor und die Arginin-Methylierung unterdrückt. Zelle 173, 706 (2018).
- L. M. Pietrek#, L. S. Stelzl#G. Hummer, Hierarchische Ensembles ungeordneter Proteine mit atomarer Auflösung in Molekulardynamiksimulationen, J. Chem. Theory Comput. 16, 725 (2020).
- Z. Benayad, S. von Bülow, L. S. Stelzl, G. Hummer, Simulation von FUS-Protein-Kondensaten mit einem angepassten grobkörnigen Modell, J. Chem. Theory Comput. 17, 525 (2021).
- L. S. Stelzl*, L. M. Pietrek*, ..., B. Schuler, M. Zweckstetter, G. Hummer, Die globale Struktur des ungeordneten Proteins Tau ergibt sich aus seiner lokalen Struktur, JACS Au. 2(3), 673-686 (2022)


